Kit FastKing RT (con gDNase)
características
■ Alta eficiencia: o FastKing RT Enzyme modifícase con motivo hidrofóbico, cunha eficiencia RT superior ao 95%.
■ Sensible: pódense identificar con precisión modelos tan baixos como 1 ng.
■ Resistencia: capaz de transcrición inversa de modelos complexos, con perfecta resistencia ás impurezas.
■ Flexible: a eliminación do ADN xenómico e a transcrición inversa completáronse por separado. Os cebadores mesturáronse por separado nun tubo, de xeito flexible para cambiar outros cebadores.
Especificación
Tipo: transcritase inversa modificada por xenes, gDNase
Procedementos: en dous pasos (eliminación de ADN xenómico e RT)
Eficiencia RT:> 95%
Modelo: 1 ng- 2 μg
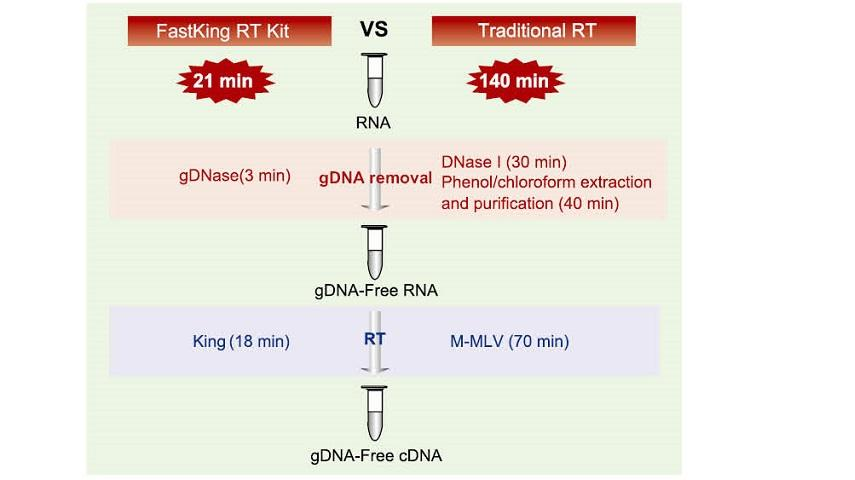
Tempo de operación: ~ 21 min
Aplicacións: o ADNc transcrito inversamente pode usarse en PCR convencional, PCR en tempo real e construción de biblioteca de ADNc.
Reacción de 21 min nun tubo
Só leva 21 minutos completar a eliminación do ADNg e o proceso de transcrición inversa eficiente no mesmo tubo sen substituír o tubo de reacción e o proceso de tratamento da DNase I. independente. En comparación co método tradicional que require unha operación de 12 pasos e unha reacción de 140 minutos, simplifica moito os pasos de operación e aforra moito tempo de operación.
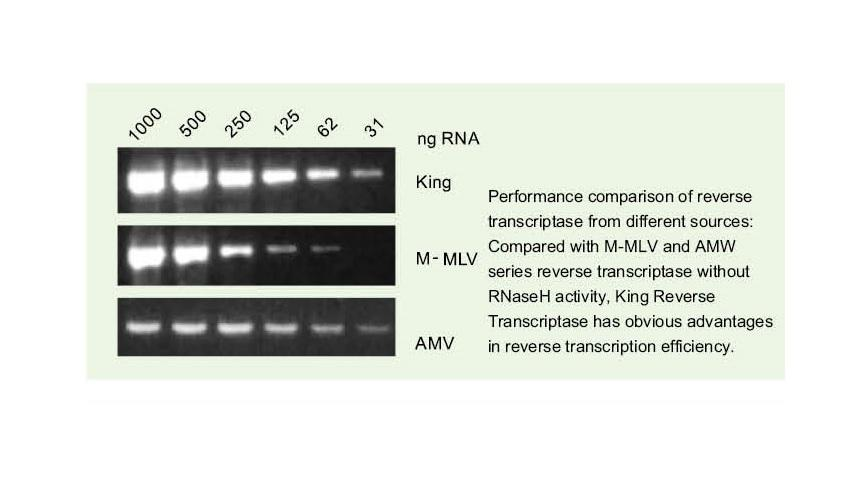
Excelente calidade de King RTase
—— Eficiencia de transcrición inversa ultra alta
—— A eficiencia da transcrición inversa é superior ao 95%
A transcritase inversa xeral ten unha eficiencia de transcrición inversa do 40-60%, e o rendemento de ADNc pode aumentarse cunha maior cantidade de carga de ARN. A transcritase inversa King pode acadar unha eficiencia de transcrición inversa superior ao 95% debido á súa alta afinidade exclusiva polos modelos de ARN. Polo tanto, os experimentos posteriores pódense satisfacer sen a necesidade dunha gran cantidade de entrada de ARN, o que aforra ARN e permite unha alta pureza e alto rendemento de ADNc.
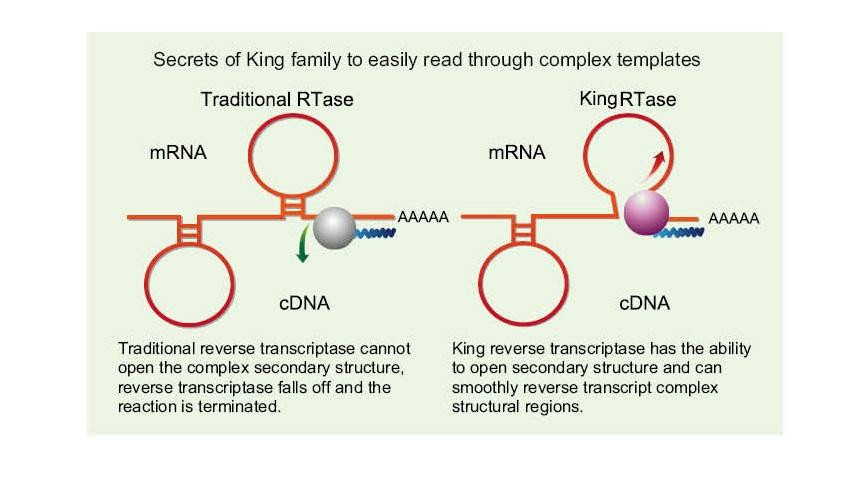
Fácil de ler a través de modelos complexos
——Fácil de ler a través de modelos GC elevados e complexos
O ARN monocatenario ten unha ampla gama de rexións complexas de estrutura secundaria debido ao enlace de hidróxeno entre as cadeas. A transcritase inversa ordinaria pode levar á terminación da transcrición inversa cando se atopa cunha estrutura secundaria complexa, polo tanto, non pode completar con éxito a síntese de ADNc. Non obstante, a nova xeración de transcriptase inversa King ten un dominio estrutural único, que pode destruír o enlace de hidróxeno entre as cadeas de ARN, abrindo así a complexa estrutura secundaria do ARN e asegurando a sua transcrición inversa.
Todos os produtos pódense personalizar para ODM / OEM. Para máis detalles,faga clic en Servizo personalizado (ODM / OEM)
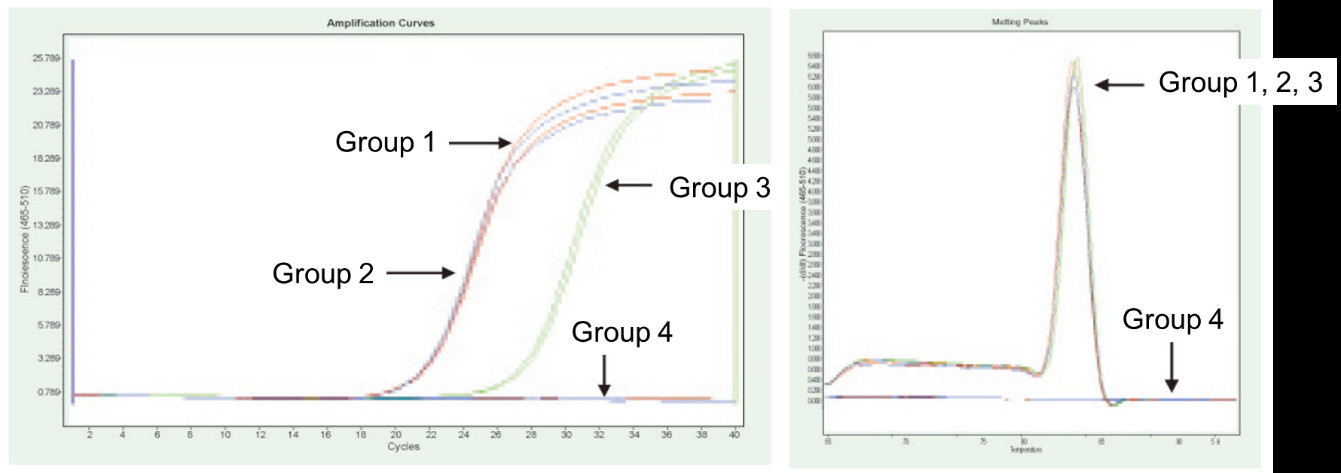 |
Grupo 1: transcrición inversa sen tratamento con gDNase; Grupo 2: sen tratamento con gDNase e sen transcrición inversa; Grupo 3: transcrición inversa despois do tratamento con gDNase; Grupo 4: tratamento con gDNase sen transcrición inversa. Métodos: detección por PCR cuantitativa de fluorescencia do xene TNF-alfa (cebador deseñado no exón con ADNc ou xenoma como molde) usando 1 μg de ARN de células Hela (con residuo de xenoma) como molde. Resultados: como se mostra na figura, o grupo 2 pode reflectir o residuo do xenoma no ARN, o grupo 3 pode reflectir con precisión o verdadeiro nivel de expresión do TNF-alfa, o grupo 1 ten erros nos resultados cuantitativos finais debido ao residuo do xenoma e o grupo 4 mostra que o FastKing RT Kit pode eliminar completamente o ADN xenómico residual en ARN. |
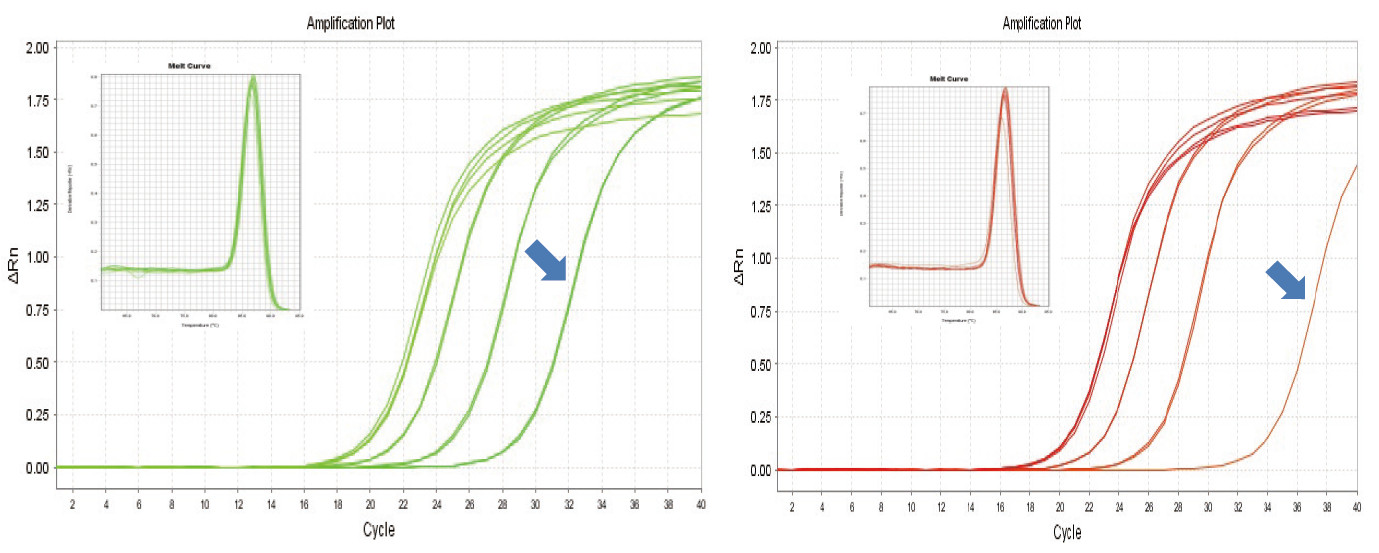 |
Figura 1. A transcrición inversa do ARN de rato realizouse usando o kit TIANGEN FastKing RT (esquerda) e produto relevante do provedor A (dereita), entón o xene MM5 amplificouse cuantitativamente usando TIANGEN SuperReal PreMix Plus (SYBR Green). Analizáronse a curva de amplificación e a curva de fusión. A entrada de ARN foi de 1000 ng, 100 ng, 10 ng e 1 ng respectivamente. Os resultados mostran que o kit TIANGEN FastKing RT ten un gradiente de transcrición inversa claro e un baixo valor de Ct, e ten vantaxes evidentes para a transcrición inversa do modelo de baixa abundancia (1 ng, frecha azul). |
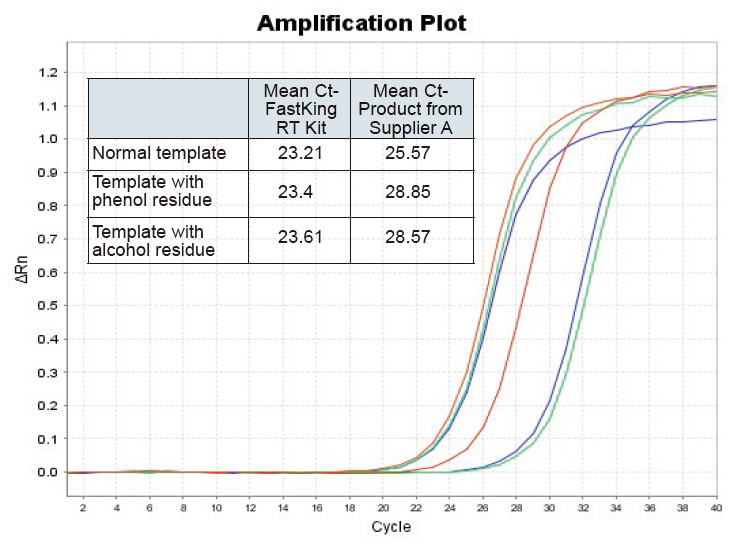 |
Figura 2. Transcrición inversa de plantilla de ARN normal (vermello), plantilla con gran residuo de fenol (verde) e plantilla con residuo de alcohol (azul) de ratas usando o kit TIANGEN FastKing RT e o produto relevante do provedor A respectivamente, cuantifique os xenes RNC usando TIANGEN SuperReal Analizáronse PreMix Plus (SYBR Green) e as curvas de amplificación e os valores de Ct. Os resultados mostran que o kit TIANGEN FastKing RT ten o valor Ct cuantitativo máis baixo despois da transcrición inversa e unha excelente resistencia á tensión e ten vantaxes evidentes para os modelos con residuos de alta impureza. |
O ARN A-1 é degradado
——Purificar o ARN de alta calidade sen contaminación. O material do que se extrae o ARN debe ser o máis fresco posible para evitar a degradación do ARN. Analiza a integridade do ARN nun xel desnaturalizado antes da reacción RT. Despois da extracción de ARN, debe almacenarse en formamida ao 100%. Se se usa un inhibidor da RNase, a temperatura de calefacción debe ser inferior a 45 ° C e o pH debe ser inferior a 8,0, se non, o inhibidor liberará toda a RNase unida. Ademais, o inhibidor da RNase debe engadirse a solucións que conteñan TDT ≥ 0,8 mM.
O ARN A-2 contén inhibidores das reaccións de transcrición inversa
—— Os inhibidores da transcrición inversa inclúen SDS, EDTA, glicerol, pirofosfato de sodio, espermidina, formamida, sal de guanidina, etc. Mestura o ARN control coa mostra e compara o rendemento coa reacción de ARN control para comprobar se hai un inhibidor. Lavar a precipitación de ARN cun etanol ao 70% (v / v) para eliminar os inhibidores.
A-3 Recocimento insuficiente de cebadores usados para sintetizar a primeira cadea de ADNc
—— Determinar que a temperatura de recocido é adecuada para os cebadores utilizados no experimento. Para hexámeros aleatorios, recoméndase manter a temperatura a 25 ° C durante 10 minutos antes de alcanzar a temperatura de reacción. Para cebadores específicos de xenes (GSP), proba con outros GSP ou cambia a oligo (dT) ou hexámero aleatorio.
A-4 Pequena cantidade de ARN inicial
——Aumentar a cantidade de ARN. Para mostras de ARN de menos de 50 ng, pódese empregar 0,1 μg a 0,5 μg de acetilo BSA na primeira síntese de ADNc de cadea
A-5 A secuencia diana non se expresa nos tecidos analizados.
——Proba outros tecidos.
A reacción da PCR A-6 falla
——Para RT-PCR en dous pasos, o modelo de ADNc no paso PCR non pode superar 1/5 do volume de reacción.
A-1 Recocido non específico de cebadores e plantillas
—— O extremo 3 'dos cebadores non debe conter 2-3 dG ou dC. Use cebadores específicos de xenes na primeira síntese de cadeas en lugar de cebadores aleatorios ou oligo (dT). Empregue unha temperatura de recocido máis alta nos primeiros ciclos e logo unha temperatura de recocimento máis baixa. Use a ADN polimerase Taq de inicio quente para PCR para mellorar a especificidade da reacción.
A-2 Pobre deseño de cebadores específicos de xenes
——Siga os mesmos principios para o deseño de imprimación de amplificación.
ARN A-3 contaminado con ADN xenómico
——Tratar ARN con DNase PCR de grao I. Configure unha reacción de control sen transcrición inversa para detectar a contaminación do ADN.
A-4 Formación do dímero de imprimación
——Deseñar cebadores sen secuencias complementarias no extremo 3 '.
A-5 Mg moi alto2+ concentración
——Optimize Mg2+ concentración para cada combinación de modelo e imprimación
A-6 Contaminado con ADN alleo
—— Use puntas resistentes aos aerosois e encimas UDG.
A-1 O contido do primeiro produto de cadea é demasiado alto
——Reducir a cantidade do produto da primeira cadea na etapa de reacción PCR convencional.
A-2 Cantidade de imprimación demasiado alta na reacción de PCR
——Reducir a entrada de imprimación.
A-3 Demasiados ciclos
——Optimize condicións de reacción PCR e reducir o número de ciclo de PCR.
A-4 Temperatura de recocido demasiado baixa
—— Aumentar a temperatura de recocido para evitar iniciación e extensión non específicas.
A-5 Amplificación non específica de fragmentos de oligonucleótidos xerados pola degradación da ADNase por DNase: extrae ARN de alta calidade para evitar a contaminación do ADN.
RT-PCR consiste en transcribir inversamente o ARN en ADNc e despois usar o ADNc transcrito inversamente como modelo para a reacción da PCR para amplificar o fragmento diana. Escolla cebadores aleatorios, Oligo dT e cebadores específicos de xenes segundo as condicións específicas do experimento. Todos os cebadores anteriores poden usarse para o ARNm de células eucariotas curtas sen estrutura de horquilla.
Imprimación aleatoria: Adecuado para ARN longo con estrutura de horquilla, así como para todo tipo de ARN como ARNr, ARNm, ARNt, etc. Utilízanse principalmente para a reacción RT-PCR dun único molde.
Oligo dT: Adecuado para o ARN con cola PolyA (o ARN procariota, o ARNc e Oligo dT e ARC ARN eucariota non teñen colas PolyA). Debido a que Oligo dT está unido á cola PolyA, é necesario que a calidade das mostras de ARN sexa alta e incluso unha pequena cantidade de degradación reducirá moito a cantidade de síntese de ADNc de lonxitude completa.
Imprimación xenética: Complementaria á secuencia modelo, adecuada para situacións nas que se coñece a secuencia diana.
Hai dous xeitos:
1. Método de referencia interna: en teoría, o ADNc é fragmentos de ADN de diferentes lonxitudes, polo que o resultado da electroforese é o frotis. Se a abundancia de ARN é baixa, ningún produto aparecerá na electroforese, pero isto non significa que ningún produto se amplifique mediante PCR. En xeral, pódese usar referencia interna para detectar ADNc. Se a referencia interna ten resultados, pódese garantir basicamente a calidade do ADNc (nalgúns casos, se o fragmento do xene diana é demasiado longo, pode haber excepcións).
2. Se hai un xene coñecido amplificado por este modelo, pódese comprobar cos cebadores deste xene. A amplificación da referencia interna non significa necesariamente que non haxa ningún problema co ADNc. Debido a que a referencia interna ten unha gran abundancia en ADNc, é fácil de amplificar. Se o ADNc está parcialmente degradado por varias razóns, desde a perspectiva da probabilidade, os resultados da PCR de xenes diana de baixa abundancia veranse moi afectados. Aínda que a referencia interna segue sendo abundante, a amplificación probablemente non se verá afectada.
Degradar parcialmente o ARN. Detectar a integridade e purificar o ARN
O contido de ARN de distintas especies pode ser diferente, pero en xeral, o ARN total extraído debe conter dúas bandas claras 28S e 18S en electroforese en xel e o brillo da banda anterior debería ser o dobre que o da segunda. A banda 5S indica que o ARN se degradou e que o seu brillo é proporcional ao grao de degradación. A amplificación exitosa da referencia interna non significa que non haxa ningún problema co ARN, porque a referencia interna é moi abundante, o ARN pode amplificarse sempre que a degradación non sexa grave. O OD260/ OD280a proporción de ARN puro medida por espectrofotómetro debe estar entre 1,9 e 2,1. Unha pequena cantidade de impureza de proteínas no ARN reducirá a proporción. Mentres o valor non sexa demasiado baixo, a RT non se verá afectada. O que máis importa para RT é a integridade do ARN.
A extensión do xene de referencia interno só pode indicar que RT tivo éxito, pero non necesariamente está relacionado coa calidade da cadea de ADNc. Debido a que os fragmentos de referencia interna son xeralmente de pequeno tamaño e de alta expresión, son máis fáciles de ter éxito na transcrición inversa. Non obstante, o tamaño e a expresión do xene diana varía dun xene a outro. A calidade do ADNc non se pode xulgar só por referencia interna, especialmente para os fragmentos diana de máis de 2 kb.
Algunhas mostras teñen estruturas secundarias complexas ou teñen un contido rico en GC ou son preciosas con pouca abundancia. Nestes casos, debería seleccionarse a transcriptase inversa adecuada segundo o tamaño do fragmento obxectivo e da mostra. Para as plantillas de ARN con alto contido de GC e estrutura secundaria complexa, é difícil abrir a estrutura secundaria a baixa temperatura ou cunha transcritase inversa común. Para estes modelos, pódese seleccionar Quant Reverse Transcriptase, xa que o seu rendemento de transcrición inversa é obviamente mellor que o da transcriptase inversa da serie M-MLV, que pode transcribir de forma eficiente varios modelos de ARN de xeito eficiente e transcribir o ARN na primeira cadea de ADNc na medida máxima. Cando se usa un kit de transcritase inversa xeral, o sistema de 20 μl só pode transcribir de forma efectiva 1 μg de ARN total. Preste atención á capacidade máxima do kit RT. Se o modelo se engade en exceso, a transcrición inversa favorecerá o ARN con abundancia. Polo tanto, é mellor non superar a capacidade máxima do sistema.
A-1 Determine se o ARN se degrada severamente e se o RT ten éxito
En xeral, a razón do fracaso da amplificación de referencia interna adoita ser causada por unha grave degradación do ARN. Outro motivo posible é o fallo da transcrición inversa. A referencia interna non se pode usar como estándar para xulgar a calidade da cadea única de ADNc, pero pode usarse como estándar para xulgar se a transcrición inversa ten éxito se non hai ningún problema de calidade do ARN. O máis importante no proceso de transcrición inversa é manter unha temperatura constante e un sistema de reacción constante para mellorar a eficiencia da reacción.
A-2 Determine se os cebadores para amplificar xenes de referencia internos son fiables e se hai algún problema cos reactivos empregados na PCR.
Para a cuantificación relativa, o ARN debe cuantificarse antes da transcrición inversa, o que tamén é necesario en moitos kits de transcrición inversa, por exemplo, cuantificar a entrada de ARN como 1 μg. Dado que o ADNc transcrito inversamente é unha solución mixta, incluíndo ARN, oligo dT, encima, dNTP e incluso un pouco de residuo de ADN, producirase desviación, polo que é imposible cuantificar con precisión o ADNc. Polo tanto, é necesaria a cuantificación do ARN. Considerando que a eficiencia da transcrición inversa é a mesma entre as distintas mostras, a cantidade de ADNc obtida debería ser a mesma e a análise cuantitativa pode amosar a comparación dos niveis de expresión de diferentes xenes na mesma cantidade de ARN total. Ao realizar PCR cuantitativa de fluorescencia relativa, é posible que non se precise un ADNc cuantitativo despois da transcrición inversa porque o xene de referencia interno pode actuar como referencia.
Está relacionado principalmente cos xenes e a transcrición inversa do fragmento longo non é factible para a maioría dos xenes. En primeiro lugar, a eficiencia da transcrición inversa é moi inferior á da PCR. En segundo lugar, a rexión rica en GC e a estrutura secundaria de moitos xenes restrinxen a transcrición inversa e a PCR. Finalmente, a fidelidade e a eficiencia de amplificación da PCR son difíciles de garantir ao mesmo tempo. No proceso de transcrición inversa, ninguén pode garantir a obtención de fragmentos longos para xenes con pouca copia, especialmente usando oligo dT. En canto ao 5 'UTR con máis GC, é aínda máis difícil. Polo tanto, aínda é un método razoable para inverter a transcrición con cebadores aleatorios, atopar os sitios de escisión naturais no fragmento diana, amplificar por segmentos e despois realizar a dixestión e ligadura de restrición. En xeral, é difícil amplificar directamente fragmentos de máis de 2 kb, pero non sempre é imposible obter: 1. En primeiro lugar, garantir a integridade do ARN / ARNm e prefírese a extracción de TRIZOL. 2. Pódese usar directamente o kit M-MLV RT-PCR. Amplíe o tempo de recocido e aumente o número de ciclos no proceso de amplificación correctamente. Alternativamente, pódese aplicar PCR aniñada ou realizar unha ou dúas reaccións primeiro cunha desnaturalización e tempo de extensión adecuadamente estendidos antes da amplificación normal de PCR, o que pode axudar a estender fragmentos. Preste atención á fidelidade da polimerase. 3. Long Taq pode usarse en PCR para obter resultados ideais. 4. Para a aplicación de expresión de proteínas, debería aplicarse a polimerase de alta fidelidade.
TIANGEN ofrece dous tipos de transcritasa inversa: Quant / King RTase e TIANScript M-MLV. A principal diferenza entre eles é a cantidade de entrada de modelos. Quant é unha transcritase inversa única, que é diferente da M-MLV de uso común derivada do virus da leucemia murina Moloney. Quant é unha nova transcriptase inversa de alta eficiencia expresada de forma recombinante por Enxeñaría Escherichia coli. Quant é adecuado para amplificar 50 ng-2 μg de ARN con alta actividade transcricional inversa e alto rendemento. En comparación con MMLV ou AMV comúns, a característica máis grande de Quant é que ten unha afinidade moi forte cos modelos de ARN e pode revertir modelos complexos de transcrición sen desnaturalizar a altas temperaturas. Para os modelos con maior contido de GC, a eficiencia inversa é maior. Non obstante, esta transcriptase inversa ten actividade RNase H, que pode afectar a lonxitude do produto de ADNc (adecuado para modelos de <4,5 kb). Para a transcrición inversa convencional, recoméndase a transcriptase inversa TIANScript MMLV. Esta RTase é un encima modificado cunha actividade RNase H moi feble, que é adecuado para a síntese de ADNc longa (> 5 kb).
A transcrición inversa dun paso e a amplificación por PCR complétanse no mesmo tubo sen abrir a tapa do tubo entre a síntese de ADNc e a amplificación, o que é útil para reducir a contaminación. Dado que todas as mostras de ADNc obtidas úsanse para a amplificación, a sensibilidade é maior, cun mínimo de 0,01 pg de ARN total. Para un RTPCR dunha etapa con éxito, os cebadores específicos do xene utilízanse xeralmente para iniciar a síntese de ADNc. O método en dous pasos, a saber, a transcrición inversa e a amplificación por PCR lévase a cabo en dous pasos. En primeiro lugar lévase a cabo a transcrición inversa a partir dun molde de ARN para obter ADNc, e o ADNc obtido sométese a unha ou máis reaccións de PCR diferentes. O método en dous pasos pode usar oligo (dT) ou cebadores aleatorios para guiar a síntese da primeira cadea de ADNc e pode transcribir inversamente toda a información de ARNm dunha mostra específica.
Categorías de produtos
POR QUE NOS ELIXIR
Dende a súa creación, a nosa fábrica está a desenvolver produtos de primeira clase mundial co cumprimento do principio
de calidade primeiro. Os nosos produtos gañaron unha excelente reputación na industria e confianza valiosa entre clientes novos e antigos ..










