Kit de PCR de sangue directo
características
■ Simple e rápido: a amplificación por PCR pódese realizar directamente usando o sangue como molde, sen necesidade dos tediosos pasos de preparación de mostras e extracción de ADN.
■ Alta pureza: o paso de pre-tratamento da mostra e os pasos de extracción de ADN poden axudar a evitar a contaminación cruzada das mostras.
■ Alto rendemento: a identificación por PCR para mostras a grande escala pódese realizar combinando o kit con placas de PCR de 96/384 pozos.
■ Forte universalidade: este kit pode amplificar de forma eficiente fragmentos de GC elevados ou fragmentos con estrutura secundaria complexa e a lonxitude da amplificación pode ser de ata 5 kb.
■ Forte resistencia ao estrés: este kit pódese aplicar a varias especies e mostras de sangue conservadas de diferentes xeitos.
Aplicacións
Os produtos PCR deste kit conteñen "A" no extremo 3, que se pode usar directamente para a clonación de vectores TA. Este kit pódese usar para a amplificación de fragmentos de ADN xenómico, análise xenética de alto rendemento e análise de xenotipado (como a detección de xenes).
Todos os produtos pódense personalizar para ODM / OEM. Para máis detalles,faga clic en Servizo personalizado (ODM / OEM)
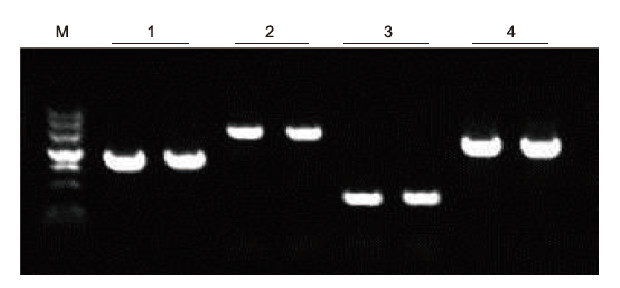 |
Empregando a anticoagulación EDTA humana como modelo, amplificáronse 4 xenes con diferentes contidos de GC mediante o kit de PCR de sangue directo. O sistema de reacción da PCR foi de 20 μl e empregouse 1 μl de sangue como molde. M: TIANGEN Marker II; 1: tamaño do fragmento 1090 pb, contido GC 68,1%; 2: tamaño do fragmento 1915 pb, contido GC 70,4%; 3: tamaño do fragmento 448 pb, contido GC 74,8%; 4: tamaño do fragmento 1527 pb, contido GC do 61,5%. Resultados experimentais: o kit de PCR de sangue directo pode amplificar de forma eficaz fragmentos de ADN co contido de GC no rango do 61,5% ao 74,8%, o que suxire que é capaz de amplificar fragmentos de alto contido de GC. |
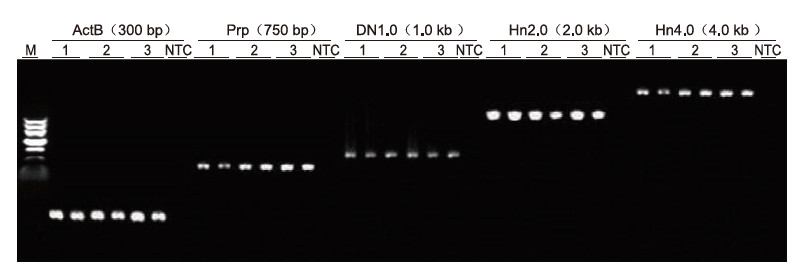 |
Empregando a anticoagulación EDTA humana como molde, 5 xenes de distinta lonxitude (ActB, Prp, DN1.0, Hn2.0 e Hn4.0) foron amplificados por Blood Direct PCR Kit. O sistema de reacción da PCR foi de 20 μl e empregouse 1 μl de sangue como molde. M: TIANGEN Marker II; 1-3: 3 mostras de sangue diferentes; NTC: control sen cebadores. Resultados experimentais: o kit de PCR Blood Direct pode amplificar fragmentos cunha lonxitude de ata 4 kb, o que suxire que é capaz de amplificar fragmentos longos. |
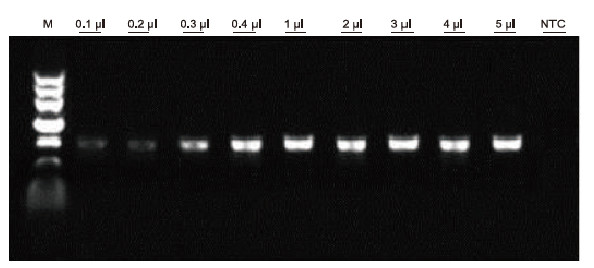 |
Usando a anticoagulación EDTA humana como modelo, empregouse o kit de PCR de sangue directo para a detección por PCR de diferentes mostras de sangue. O sistema de reacción da PCR foi de 20 μl e empregouse 1 μl de sangue como molde. M: TIANGEN Marker II; 1-9: a cantidade de carga de sangue é de 0,1 μl, 0,2 μl, 0,3 μl, 0,4 μl, 1 μl, 2 μl, 3 μl, 4 μl e 5 μl, respectivamente; NTC: control sen modelo Resultados experimentais: o kit de PCR directo ten unha forte resistencia ao sangue e pode amplificar as mostras de sangue co rango de carga de 0,1-5 μl. |
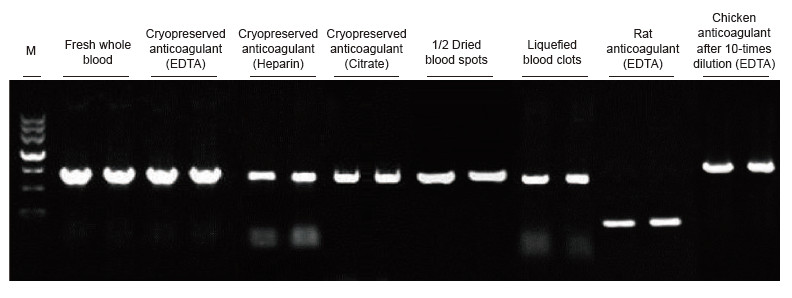 |
Empregáronse mostras de sangue de especies humanas, de ratas, de polo e doutras especies con diferentes tratamentos. O kit de PCR directo de sangue utilizouse para amplificar PRNP (humano, 750 pb), Actina (rata, 200 pb) e β-Actina (Pollo, 1,0 kb). O sistema de reacción da PCR foi de 20 μl e empregouse 1 μl de sangue como molde. M: TIANGEN Marker II. Resultados experimentais: o kit de PCR directo de sangue pódese aplicar nunha ampla gama de mostras e a detección directa de PCR pode realizarse en mostras de sangue de varias especies con diferentes tratamentos. |
Modelo A-1
■ O modelo contén impurezas de proteínas ou inhibidores de Taq, etc. —Purificar o modelo de ADN, eliminar as impurezas de proteínas ou extraer o ADN modelo con kits de purificación.
■ A desnaturalización do modelo non está completa - Aumentar adecuadamente a temperatura de desnaturalización e prolongar o tempo de desnaturalización.
■ Degradación do modelo: prepara de novo o modelo.
Imprimación A-2
■ Mala calidade dos cebadores ——Resintetiza o cebador.
■ Degradación de imprimación ——Aliquot os cebadores de alta concentración en pequeno volume para a súa conservación. Evite a conxelación e desconxelación múltiple ou crioconservación a longo prazo de 4 ° C.
■ Deseño inadecuado dos cebadores (por exemplo, a lonxitude do cebador non é suficiente, o dímero formado entre os cebadores, etc.).
A-3 Mg2+concentración
■ Mg2+ a concentración é demasiado baixa —— Aumentar adecuadamente Mg2+ concentración: Optimizar o Mg2+ concentración por unha serie de reaccións de 1 mM a 3 mM cun intervalo de 0,5 mM para determinar o Mg óptimo2+ concentración para cada modelo e cartilla.
A-4 Temperatura de recocido
■ A alta temperatura de recocido afecta á unión da imprimación e do molde. ——Reducir a temperatura de recocido e optimizar o estado cun gradiente de 2 ° C.
A-5 Tempo de ampliación
■ Tempo de extensión curto —— Aumentar o tempo de extensión.
Fenómenos: as mostras negativas tamén mostran as bandas de secuencia obxectivo.
A-1 Contaminación de PCR
■ Contaminación cruzada de produtos de amplificación ou de secuencia diana ——Para non pipetar con precaución a mostra que contén a secuencia diana na mostra negativa nin derramalos fóra do tubo da centrífuga. Os reactivos ou equipos deben ser autoclavados para eliminar os ácidos nucleicos existentes e a existencia de contaminación debe determinarse mediante experimentos de control negativo.
■ Contaminación dos reactivos ——Aliquote os reactivos e almacénelos a baixa temperatura.
A-2 Primer
■ Mg2+ a concentración é demasiado baixa —— Aumentar adecuadamente Mg2+ concentración: Optimizar o Mg2+ concentración por unha serie de reaccións de 1 mM a 3 mM cun intervalo de 0,5 mM para determinar o Mg óptimo2+ concentración para cada modelo e cartilla.
■ Deseño de cebador incorrecto e a secuencia diana ten homoloxía coa secuencia non diana. —— Cebadores de redeseño.
Fenómenos: as bandas de amplificación de PCR son incompatibles co tamaño esperado, grande ou pequeno, ou ás veces prodúcense ambas bandas de amplificación específicas e bandas de amplificación non específicas.
A-1 Imprimación
■ Mala especificidade da imprimación
—— Imprimación de redeseño.
■ A concentración de imprimación é demasiado elevada —— Aumenta adecuadamente a temperatura de desnaturalización e prolonga o tempo de desnaturalización.
A-2 Mg2+ concentración
■ O Mg2+ a concentración é demasiado alta ——Reducir adecuadamente a concentración de Mg2 +: Optimizar o Mg2+ concentración por unha serie de reaccións de 1 mM a 3 mM cun intervalo de 0,5 mM para determinar o Mg óptimo2+ concentración para cada modelo e cartilla.
A-3 Polimerase termoestable
■ Cantidade excesiva de encima ——Reducir a cantidade de enzima adecuadamente a intervalos de 0,5 U.
A-4 Temperatura de recocido
■ A temperatura de recocido é demasiado baixa: aumenta axeitadamente a temperatura de recocido ou adopta o método de recocido en dúas etapas.
A-5 ciclos de PCR
■ Demasiados ciclos de PCR ——Reducir o número de ciclos de PCR.
A-1 Imprimación——Pobre especificidade ——Deseña de novo a imprimación, cambie a posición e a lonxitude da imprimación para mellorar a súa especificidade; ou realizar PCR aniñada.
Modelo ADN A-2
——A plantilla non é pura ——Purifica a plantilla ou extrae ADN con kits de purificación.
A-3 Mg2+ concentración
——Mg2+ a concentración é demasiado alta ——Reducir adecuadamente Mg2+ concentración: Optimizar o Mg2+ concentración por unha serie de reaccións de 1 mM a 3 mM cun intervalo de 0,5 mM para determinar o Mg óptimo2+ concentración para cada modelo e cartilla.
A-4 dNTP
——A concentración de dNTP é demasiado alta ——Reduce a concentración de dNTP adecuadamente
A-5 Temperatura de recocido
——Temperatura de recocido demasiado baixa—— Aumentar adecuadamente a temperatura de recocido
Ciclos A-6
——Moitos ciclos ——Optimiza o número de ciclos

O primeiro paso é escoller a polimerase axeitada. A polimerase Taq regular non pode revisarse debido á falta de actividade de exonucleasa 3'-5 ', e o desaxuste reducirá moito a eficiencia de extensión dos fragmentos. Polo tanto, a polimerase Taq regular non pode amplificar con eficacia fragmentos diana maiores a 5 kb. A taq polimerase con modificación especial ou outra polimerase de alta fidelidade debe seleccionarse para mellorar a eficiencia da extensión e satisfacer as necesidades de amplificación de fragmentos longos. Ademais, a amplificación de fragmentos longos tamén require un axuste correspondente do deseño da imprimación, o tempo de desnaturalización, o tempo de extensión, o pH do tampón, etc. Normalmente, os imprimadores con 18-24 pb poden levar a un mellor rendemento. Para evitar danos na plantilla, o tempo de desnaturalización a 94 ° C debería reducirse a 30 segundos ou menos por ciclo e o tempo para subir a temperatura a 94 ° C antes da amplificación debería ser inferior a 1 min. Ademais, establecer a temperatura de extensión a uns 68 ° C e deseñar o tempo de extensión segundo a velocidade de 1 kb / min pode garantir unha amplificación efectiva de fragmentos longos.
A taxa de erro da amplificación por PCR pode reducirse empregando varias ADN polimerasas con alta fidelidade. Entre todas as ADN polimerases de Taq atopadas ata o momento, o encima Pfu ten a taxa de erro máis baixa e a fidelidade máis alta (ver táboa adxunta). Ademais da selección de encimas, os investigadores poden reducir aínda máis a taxa de mutación da PCR optimizando as condicións de reacción, incluíndo a composición do tampón, a concentración de polimerase termoestable e o número de ciclos de PCR.
Categorías de produtos
POR QUE NOS ELIXIR
Dende a súa creación, a nosa fábrica está a desenvolver produtos de primeira clase mundial co cumprimento do principio
de calidade primeiro. Os nosos produtos gañaron unha excelente reputación na industria e confianza valiosa entre clientes novos e antigos ..








